高三化学电化学教案(高三电化学做题技巧)
导语:高三化学复习专题五 电化学











Ⅰ.原电池
【考点1】原电池原理
1.构成条件
(1) 自发的氧化还原反应:(强还原剂在负极上自发的失去电子,被氧化;氧化剂在正极上自发的得到电子,被还原。)
(2) 两个不同材料的电极:两极都是固体材料。正极:能导电的固体,两个作用:一是只导电,不参加反应。参加反应的是溶液中的离子或溶于溶液中的氧化性气体。二是即导电又作氧化剂。
负极:一是比正极活泼的金属,作还原剂参加反应;二是楕性电极,只导电不参加反应。
(3) 电解质溶液:溶液中离子的移动方向:正向正,负向负。
(4) 形成闭合回路:电子不能通过溶液。电流可通过溶液。
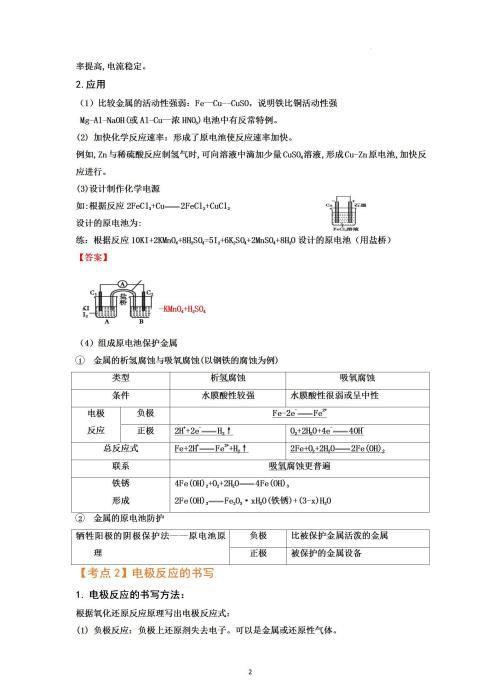
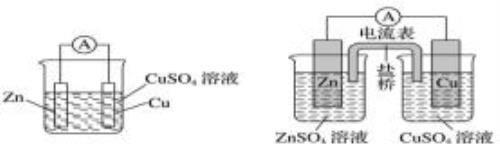 有盐桥的原电池:①盐桥作用:a.隔绝正负极反应物,避免直接接触,导致电流不稳定;b.通过离子的定向移动,构成闭合回路;c.平衡电极区的电荷。
有盐桥的原电池:①盐桥作用:a.隔绝正负极反应物,避免直接接触,导致电流不稳定;b.通过离子的定向移动,构成闭合回路;c.平衡电极区的电荷。
②装置Ⅰ中有部分Zn与Cu2+直接反应,使电池效率降低;装置Ⅱ中使Zn与Cu2+隔离,电池效率提高,电流稳定。
2.应用
(1)比较金属的活动性强弱:Fe—Cu--CuSO,说明铁比铜活动性强
Mg-Al-NaOH(或Al-Cu—浓HNO3)电池中有反常特例。
(2) 加快化学反应速率:形成了原电池使反应速率加快。
例如,Zn与稀硫酸反应制氢气时,可向溶液中滴加少量CuSO4溶液,形成Cu-Zn原电池,加快反应进行。
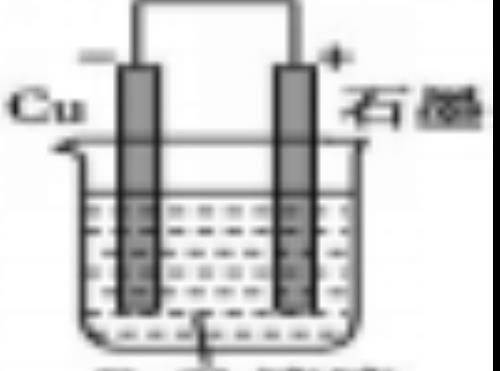 (3)设计制作化学电源
(3)设计制作化学电源
如:根据反应2FeCl3+Cu 2FeCl2+CuCl2
2FeCl2+CuCl2
设计的原电池为:
练:根据反应10KI+2KMnO4+8H2SO4=5I2+6K2SO4+2MnSO4+8H2O设计的原电池(用盐桥)
【考点2】电极反应的书写
1. 电极反应的书写方法:
根据氧化还原反应原理写出电极反应式:
(1) 负极反应:负极上还原剂失去电子。可以是金属或还原性气体。
负极失去电子发生氧化反应。负极失去多少个电子,依据反应前后化合价的变化来计算。
注意:负极反应生成的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应写入负极反应式。
如果要加H+或OH-使电荷平衡,负极左边加OH-,右边加H+。
(2) 正极反应:正极上氧化剂得到电子。溶液中的氧化性离子或溶于其中的氧化性气体以及氧化性的金属氧化物。
正极得到电子发生还原反应。正极得到电子的多少,也要依据反应前后化合价的变化来计算。
注意:正极反应生成的阴离子(或阳离子)与电解质溶液中的阳离子(或阴离子)是否共存。若不共存,则该电解质溶液中的阳离子(或阴离子)应写入负极反应式。
例如:当正极上的反应物质是O2时:若电解质溶液为中性或碱性,则水必须写入正极反应式中,O2生成OH-,写为O2+2H2O+4e-===4OH-;
若电解质溶液为酸性,则H+必须写入正极反应式中,O2生成水,写为O2+4H++4e-===2H2O。如果是K2CO3,正极通CO2,则正极反应为:O2+4e-+2CO2=2CO32-
2.几种常见原电池电极反应的书写:
(1)负极参加反应,还原剂失电子,发生氧化反应;正极材料不反应:
① .Fe-Cu-CuSO4
负极:Fe-2e=Fe2+
正极:Cu2++2e=Cu
总反应:
② Fe-C-NaCI(O2)。
负极:Fe-2e=Fe2+
正极:O2+4e+2H2O=4OH-
总反应:
③ Al-Mg-NaOH。
负极:Al-3e-+4OH-=AlO2-+2H2O
正极:2H2O+2e=H2↑+2OH-
总反应:
④ Al-H2O2-KOH负极:
Al-3e-+4OH-=AlO2-+2H2O
正极:H2O2+2e=2OH-
总反应:
⑤ Zn—碳棒—MnO2(KOH):
负极:Zn+2OH--2e- Zn(OH)2
Zn(OH)2
正极:2MnO2+2H2O+2e- 2MnO(OH)+2OH-
2MnO(OH)+2OH-
总反应:
(2)正极、负极材料都参加反应。
负极:还原剂失电子,发生氧化反应;正极:氧化剂得电子,发生还原反应:
⑥ Pb-PbO2-H2SO4 负极:Pb-2e+SO42-=PbSO4 正极:PbO2+2e+4H++SO42-=PbSO4+2H2O
总反应:
⑦ Zn—Ag2O—KOH负极:Zn+2OH--2e- Zn(OH)2 正极:Ag2O+H2O+2e-
Zn(OH)2 正极:Ag2O+H2O+2e- 2Ag+2OH-
2Ag+2OH-
总反应:
(3)负极、正极材料都不参加反应(燃料电池):
① CH4-O2-H2SO4 负极: CH4-8e+2H2O=CO2+8H+ 正极:O2+4e+4H+=H2O
总反应:
② CH4-O2-NaOH 负极:CH4-8e+10OH-=CO32-+7H2O 正极:O2+4e+2H2O=4OH-
总反应:
③ CH4-O2-K2CO3 负极:CH4-8e+4CO32-=5CO2+2H2O正极:O2+4e+2CO2=2CO32-
总反应:
④ C3H8-O2-H2SO4负极:C3H8-20e+6H2O=3CO2+20H+ 正极:O2+4e+4H+=2H2O
总反应:
⑤ C3H8-O2-NaOH负极:C3H8-20e+26OH-=3CO32-+17H2O 正极:O2+4e+2H2O=4OH-
总反应:
⑥ C3H8-O2-K2CO3负极:C3H8-20e+10CO32-=13CO2+4H2O 正极:O2+4e+2CO2=2CO32-
总反应:
(4)M(Li)、M(H2)、C6(Li)等物质电极反应的书写:
M和C6都是吸附Li、H2的材料,化合价为0.
例:C6(Li)-e-=Li++C6
LixCn-xe-==xLi++nC
【考点3】原电池中要牢记重要的五个问题
1.正极电势高,负极电势低,电流:正出负入,电子:负出向正入。
2.电子不通过电解质溶液。
3.电解质溶液中,离子流向:正向正,负向负。
4.电解质溶液PH值的变化:正极(阴极)附近PH变大或显碱性,负极(阳极)附近PH变小或显酸性。
5.充电时,与电源的两极相连:正连正,负连负。
Ⅱ.电解池
【考点1】电解原理:电解质溶液的导电过程。
构成电解池:(1)要有电源:电势高的电极叫正极,电势低的电极叫负极,电流正极出,电子负极出。
(2)有两个电极:发生氧化反应的极叫阳极,与电源的正极相连,阳极上的离子失去电子;发生还原反应的极叫阴极,与电源的负极相连,阴极上的离子得到电子。
(3)有电解质溶液:电子不能通过电解质溶液,要通过离子运动导电。阳离子向阴极移动,在阴极上得到电子,被还原;阴离子向阳极移动,在阳极上失去电子,被氧化。
电解质溶液导电必然发生氧化还原反应。
【考点2】书写电极反应
1.书写电极反应:
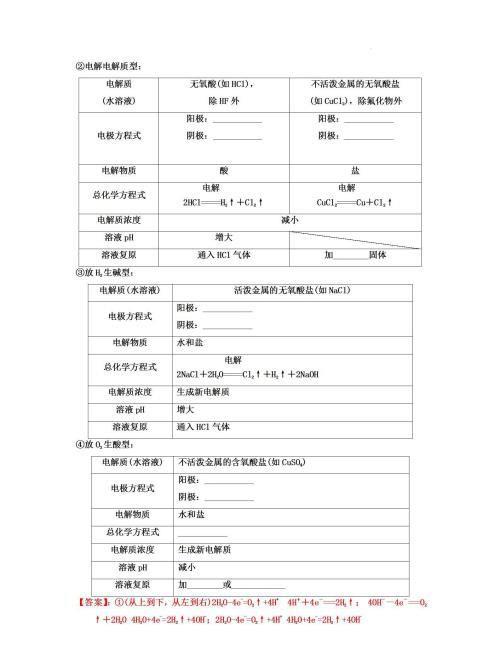
(1)一看电极材料,若是金属(Au、Pt除外)作阳极,金属一定被氧化(注:Fe生成Fe2+)。若是惰性电极,则看溶液中存在什么离子,按放电顺序进行放电反应。
(2)二看介质,介质是否参与电极反应。其中的H+和OH-,要看是水电离的H+和OH-,还是酸或碱电离出的H+和OH-,电极反应书写方法不相同。电解产生的H+或OH-能否与溶液中的某些离子发生反应,如果能发生反应,则这个离子也要与入电极反应。
(3)三看是否有特殊信息,如电解制取氧化铝,因而阳极产物不能是Al3+;再如电镀AI的非水体系,且不产生其他离子,因而离子只能在Al2Cl7(-)和AlCl4(-)之间转化。
2.熟记放电顺序:
阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
阳极:金属电极>S2->I->Br->Cl->OH->含氧酸根离子(NO3(-)、SO4(2-)、CO3(2-))>F-。
免责声明:本站部份内容由优秀作者和原创用户编辑投稿,本站仅提供存储服务,不拥有所有权,不承担法律责任。若涉嫌侵权/违法的,请反馈,一经查实立刻删除内容。本文内容由快快网络小蔼创作整理编辑!