> 社会
判断溶液中离子能否大量共存的方法(判断溶液中离子浓度大小)
导语:理综化学知识点——判断溶液中离子能否大量共存

离子在溶液中能否大量共存,涉及离子的性质及溶液酸碱性等综合知识。凡能使溶液中因反应发生使有关离子浓度显著改变的均不能大量共存。如生成难溶、难电离、气体物质或能转变成其他种类的离子(包括氧化还原反应)。
一般可从以下几方面考虑:
一、弱碱阳离子只存在于酸性较强的溶液中。

二、弱酸阴离子只存在于碱性溶液中。

三、弱酸的酸式阴离子在酸性较强或碱性较强的溶液中均不能大量共存。
它们遇强酸(H+)会生成弱酸分子;遇强碱(OH-)生成正盐和水。
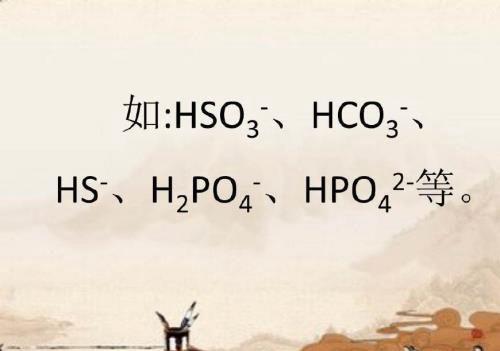
四、若阴、阳离子能相互结合生成难溶或微溶性的盐,则不能大量共存。
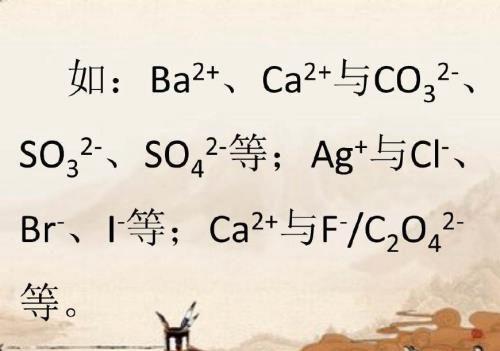
五、若阴、阳离子发生双水解反应,则不能大量共存。
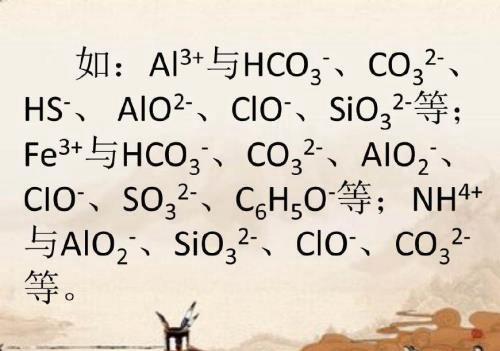
六、若阴、阳离子能发生氧化还原反应则不能大量共存。
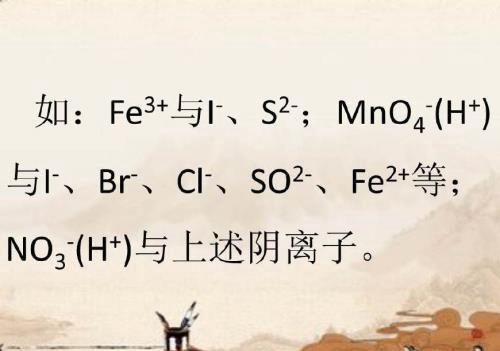
七、因络合反应或其他反应而不能大量共存。


免责声明:本站部份内容由优秀作者和原创用户编辑投稿,本站仅提供存储服务,不拥有所有权,不承担法律责任。若涉嫌侵权/违法的,请反馈,一经查实立刻删除内容。本文内容由快快网络小余创作整理编辑!